Въведение
Цялата тази книга е посветена на справянето с въздействието на затлъстяването, метаболитния синдром и диабета върху гестационните проблеми. Всички тези клинични състояния са свързани с възпалението, предизвиквано от диетата. В резултат, използването на противовъзпалителни диети при в рискови групи от населението може би е най-рентабилния начин да се постигнат по-добри резултати по време на бременността за майката и детето.
Възпалението е нож с две остриета. То ни позволява да се защитаваме срещу микробни нашественици и на разрешава да лекуваме нараняванията си. Но от друга страна, ако възпалителния отговор не е достатъчно отслабен, възпалението може да атакува собствените ни органи, което води до по-ранно развитие на хронични заболявания. Поддържането на възпалението в зона, която не е твърде ниска или твърде висока е един от ключовите фактори не само за успеха на бременността, но и за успешното стареене чрез намаляване на по-ранната поява на хронично заболяване. Обаче освен микробната инвазия или физическите наранявания, които могат да активират възпалителните ни отговориHowever, това може да направи и диетата.
Диетите могат да са или провъзпалителни, или противовъзпалителни в зависимост от хормоналните отговори, които генерират. Това е така, защото тези хормонални отговори, както и специфични хранителни вещества в диетата са тясно свързани с най-примитивната част от нашите възпалителни отговори: вродената имунна система. Тази част от нашата имунна система е еволюционно консервативна в продължение на стотици милиони години и може да се счита за нашата първа линия на защита в генерирането на възпаление. Важното е, че вродената имунна система е под значителен контрол от храненето.
Възпаление на молекулярно ниво
Централния хъб на вродената имунна система е генния транскрипционен фактор, ядрения фактор kappaB (NF-ΚB). Това е превключвателят, който включва експресията на възпалителни генни продукти (COX-2, TNFα, IL-1β, IL-6, и т.н.), което увеличава първоначалните възпалителни сигнали към съседните клетки.
Има редица хранителни фактори, които могат да активират NF-ΚB. Тези фактори включват оксидативния стрес от излишните калории и хормоните получени от арахидоновата киселина. Допълнителните хранителни фактори включват наситените мастни киселини, крайни продукти на гликирането (AGE1) и възпалителни цитокини от околните клетки, действащи чрез специфични рецептори по повърхността на клетката, които също могат да активират NF-ΚB.
Но възпалението не е като запален пън, чийто огън в крайна сметка угасва. Възпалителният отговор се състои от две отделни фази. Първата фаза е стартирането на възпалителния отговор. Втората фаза е отзвучаването на възпалителния отговор. Фазата на отзвучаването се контролира от уникална група от хормони (резолвини, протектини и морезини) получавани от омега-3 мастните киселини. Докато фазите на стартиране и отзвучаване на възпалението са в баланс, вие сте в хомеостаза. ОТ друга страна, ако фазата на стартиране е твърде силна или фазата на отзвучаването е твърде слаба, крайният резултат е хронично слабо клетъчно възпаление. Именно това хронично клетъчно възпаление под възприятието за болка е движещата сила за развитие на затлъстяване, метаболитен синдром и диабет.
Измерване на клетъчното възпаление
Тъй като клетъчното възпаление е под възприятието за болка, измерването му е предизвикателство. Най-ранният маркер за клетъчно възпаление е С-реактивния протеин с висока чувствителност2 (hs-CRP). Този протеин се синтезира в черния дроб в отговор на повишени нива на IL-6 в кръвта. За разлика от възпалителните цитокини, които или имат кратък период на полуразпад или навлизат в кръвта в много малка концентрация, hs-CRP е протеин със сравнително дълъг живот в кръвта и затова е много по лесен за измерване. Основният клиничен недостатък на hs-CRP е, че дори слаба бактериална инфекция може бързо да повиши нивата му и като последствие той не е много надежден маркер. Освен това е маркер надолу по веригата на клетъчното възпаление за разлика на ранно предупреждение за натрупването на хронично клетъчно възпаление.
Възпалителните цитокини изразени чрез активирането на NF-ΚB (като TNF, IL-1β и IL-6) са по-добри потенциални маркери за клетъчно възпаление, и все пак техните нива в кръвта са много ниски и техния кратък срок на полуразпад правят използването им като аналитични маркери на клетъчно възпаление по-малко възможно.
Може би най-добрият маркер срещу течението на клетъчното възпаление е съотношението на две мастни киселини в кръвта, омега-6 мастната киселина арахидонова киселина (АА) и омега-3 мастната киселина айкозапентаенова киселина (ЕРА). АА е градивния блок на провъзпалителните айкозаноиди, които стимулират възпалението. От друга страна, ЕРА е не само най-конкурентен инхибитор на АА за ензимите необходими за производството на възпалителни айкозаноиди, но и градивен блок за много мощни проотзвучаващи медиатори като резолвин Е1 (RvE1) и резолвин Е2 (RvE2). Така съотношението АА/ЕРА в кръвта осигурява подробно вникване в баланса на възпалението и отзвучаването му във всяка клетка на тялото. Освен това, за разлика от hs-CRP, съотношението АА/ЕРА е стабилно и надеждно и често се увеличава години преди повишаването на hs-CRP.
Определения за хронични състояния, които могат да се лекуват в противовъзпалително хранене
Въпреки че почти всяко хронично заболяване може да бъде свързано с увеличено клетъчно възпаление, трите, които са най-свързани с бременността са затлъстяването, метаболитния синдром и диабета.
Затлъстяване
Затлъстяването може да се дефинира като излишно натрупване на мазнини. Затлъстяването е малка пречка за забременяване. Обаче, когато тази излишна мазнина е възпалена, тя е проблем по време на бременност. При нормални условия мастната тъкан действа като банка, която събира енергия от храната, складира я в мастните клетки и след това я освобождава през деня. Обикновено този процес работи много добре, освен ако не е разрушен от увеличено клетъчно възпаление. В резултат индивида е постоянно уморен. В същото време клетъчното възпаление смущава сложните механизми за ситост в хипоталамуса, което води до увеличен глад.
Метаболитен синдром
Метаболитния синдром може да се счита за първия етап от метастазата на клетъчното възпаление от мастната тъкан към други органи, в частност черния дроб и мускулите. Метаболитният синдром не е определено състояние, а клъстър от свързани клинични маркери като увеличен размер на талията, високи триглицериди, нисък HDL холестерол и хиперинсулинемия. Всички тези симптоми може да са свързани с инсулинова резистентност. Метаболитният синдром може да се счита за „предиабет”, защото ако остане нелекуван, скоростта на превръщането в диабет тип 2 е 5-10% годишно.
Диабет
Диабет тип 2 се проявява с два различни механизма: инсулинова резистентност, която се дължи на липидно и цитокиново увреждане на инсулиновите рецептори, появяващо се основни в мускулите, черния дроб и мастната тъкан и разрушаване на бета клетките в панкреаса, което води до невъзможност да се секретират достатъчно количества от инсулин за контрол на нивата на кръвната захар. Делът на инсулиновата резистентност спрямо дисфункцията на бета клетките варира при различните индивиди.
С това настъпва бързо повишаване на нивата на кръвната захар с потенциално съответно увеличение на крайните продукти на гликирането (AGE), които могат да се свържат с рецепторите известни като RAGE, които също активират NF-ΚB.
Хидроксилираната мастна киселина (12-HETE), която произлиза от арахидоновата киселина явно е основния играч в разрушаването на бета клетките в панкреаса.
Хипертонияисърдечно-съдовизаболявания
Оксидативният стрес, поради претоварване с калории, хроничното слабо възпаление повлияно от дисфункция на мастната тъкан представляват омагьосан кръг, който благоприятства развитието на ендотелна дисфункция, атеротромбоза, сърдечно претоварване и дисфункция. Установено е, че увеличения прием на храна и инсулиновата резистентност също бързо повишават нивата на лептина в плазмата и впоследствие тъканната лептинова резистентност. По-високата сърдечна честота при индивиди с хиперлептинемия ще предизвика по-голямо миокардиално натоварване и в крайна сметка ще предразположи сърцето към патофизиологични промени, които навлизат в други неблагоприятни условия, създадени от „партньори” на метаболитния синдром.
Изграждане на противовъзпалителна диета
Тъй като затлъстяването, метаболитния синдром и диабета в крайна сметка се дължат на възпаление, предизвикано от диетата, логичният подход да се намали тяхното въздействие на тези свързани с възпалението състояния за майката и плода по време на бременността е майката да следва противовъзпалителна диета. Преди да опиша практическите аспекти на такава противовъзпалителна диета, нека очертая как различните макронутриенти в диетата могат да са провъзпалителни или противовъзпалителни.
Макронутриенти и възпаление
Омега-6 мастните киселини са основните градивни блокове за създаване на голямо разнообразие от провъзпалителни айкозаноиди. Но истинската молекулярна основа за провъзпалителните айкозаноиди е арахидоновата киселина, докато повечето хранителни омега-6 мастни киселини се състоят от линолова киселина. Метаболитното превръщане на линоловата киселина в арахидонова киселина минава през няколко стъпки: ензимите делта-6 и делта-5 десатураза са ензими ограничаващи скоростта, които обикновено контролират промяната на линоловата киселина в арахидонова киселина. И двата ензима са под хормонален и хранителен контрол. Хормонът инсулин (контролиран от количеството на въглехидратите в храната) активира тези ензими, докато хормонът глюкагон (контролиран от количеството на протеините в храната) инхибира тяхната активност. Количеството инсулин освободено след хранене зависи от гликемичния товар на консумираните въглехидрати. Рафинираните въглехидрати като съдържащите се в хляба, тестените продукти и преработените храни бързо се разграждат до глюкоза. Колкото по-бързо глюкозата навлиза в кръвния поток, толкова по-бързо се освобождава инсулин от панкреаса, за да отстрани излишната глюкоза от кръвообращението. От друга страна, въглехидрати като плодове и зеленчуци имат доста по-нисък гликемичен товар при хранене, което означава, че те имат много по-ограничено въздействие (особено зеленчуците несъдържащи скорбяла) в повишаването на нивата на кръвната захар. В резултат, секрецията на инсулин е значително намалена и това намалява потенциалното активиране на делата-6 и делта-5 десатуразите.
Дълговерижните омега-3 мастни киселини като айкозапентаеновата киселина (ЕРА) и докозахексаеновата киселина (DHA) са слаби инхибитори на тези ограничаващи скоростта ензими делта-6 и делта-5 десатураза, необходими за производството на арахидонова киселина. Тъй като количествата на линолова киселина се увеличават без съответното увеличаване на омега-3 мастните киселини, има постоянен натиск да се генерира повече арахидонова киселина. Когато високи нива на инсулин (генериран от диета с висок гликемичен товар) са комбинирани с високи нива линолова киселина от храната, тогава превръщането на излишната линолова киселина в арахидонова киселина значително се увеличава. Това е особено вярно, ако количествата на ЕРА и DHA са ниски. С увеличените нива на арахидоновата киселина в клетките, вероятността да се произведат повече провъзпалителни айкозаноиди е значително повишена.
Ролята на наситените мазнини в генерирането на възпаление е по-индиректна в сравнение с омега-6 мастните киселини. Toll-подобния рецептор 4 (TLR-4) взаимодейства с компонента на наситената мастна киселина липополизахарид (LPS). Наситените мазнини също могат да активират TLR-4 и така да активират NF-KB макар и при по-ниска интензивност от LPS.
Докато омега-6 и наситените мазнини за провъзпалителни, омега-3 имат провъзпалителни последици. Както беше споменато по-горе, омега-3 мастните киселини за слаби инхибитори на ензимите ограничаващи скоростта, необходими за генерирането на арахидонова киселина (АА). Те също се конкурират с АА за ензимите, необходими за генериране на айкозаноиди. Обаче различната триизмерни структури на ЕРА и DHA са доста различни и следователно водят до различни последици. В действителност ЕРА и АА са много близки по триизмерна структура, което прави ЕРА по-добър конкурентен инхибитор от DHA на ензима циклооксигеназа (СОХ), необходим за превръщането на АА в айкозаноиди, особено в простагландини и тромбоксани. В резултат колкото по-високи са нивата на ЕРА в клетъчната мембрана в сравнение с АА, по-малко вероятно е да бъдат синтезирани провъзпалителни айкозаноиди.
Но истинската противовъзпалителна мощ на омега-3 мастните киселини е в способността им да функционират като субстрати, широка гама от проотзвучаващи медиатори, която включва резолвини, протектини и морезини. Тези проотзвуаващи медиатори са ключът за намаляване нивата на хроничното клетъчно възпаление за връщане на всеки начален провъзпалителен отговор към хомеостаза.
Мононенаситените мазнини като олеиновата киселина са почти неутрални по отношение действията на айкозаноидите. В резултат, мононенаситените мазнини следва да се считат за невъзпалителни.
Накрая, роля във възпалението имат полифенолите. Полифенолите са химикалите, които придават цвят на плодовете и зеленчуците. При достатъчно големи нива, те имат противовъзпалителни действия, като активират генния транскрипционен фактор PPAR-γ, който инхибира активирането на NF-KB.
Да съберем всичко заедно
С горното кратко припомняне на хормоналните въздействията на нутриентите сега е възможно да съберем на едно място очертанията на противовъзпалителна диета.
Основен проблем в храненето е, че ако един макронутриент в храната се увеличава, тогава друг трябва да намалява. Това също означава, че хормоналните отговори причинени от конкретен хранителен макронутриент съответно също ще се увеличават или намаляват. Предизвикателството е да се намери точната комбинация на макронутриенти, която да поддържа подходяща синергия на хормонални отговори, съвместима с непрекъснатия контрол на клетъчното възпаление.
В опитите да се намери подходящия баланс на макронутриентите, той следва камбаноподобна крива, която се основава на съотношението протеини-към-гликемичен товар, както е показано на Фиг.1.
Ако съдържанието на хранителни въглехидрати в диетата е твърде високо, това ще генерира свръхпроизводство на инсулин. Ако това е придружено с големи количества омега-6 мастни киселини, това може да доведе до повишено клетъчно възпаление. На другата крайност, когато въглехидратното съдържание е твърде ниско, това генерира кетоза със съответното повишение на кортизол. Между тези две хормонални крайности лежи зона, в която нивата на инсулин и кръвна захар са стабилизирани, и като резултат има по-голяма ситост и по-малко умора.
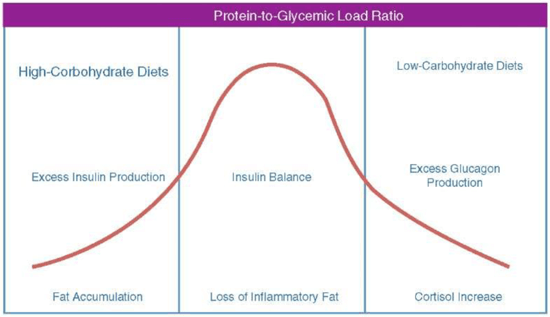
Фиг. 1 Хормонални промени като резултат на промяна на състава на макронутриентите
Друг важен въпрос, който трябва да се разгледа е количеството калории, необходими за да бъде успешна една противовъзпалителна диета. Това е важно, тъй като е показано, че консумацията на излишни калории също създава възпаление в хипоталамуса, което води до увеличен апетит.
История на противовъзпалителните диети
Първата противовъзпалителна диета беше предложена в книгата Зоната, публикувана преди 20 години. Най важната цел на тази противовъзпалителна диета беше тази, която се базира на камбановидната крива на протеини-към-гликемичен товар, показана на Фиг.1. В допълнение, имаше силен акцент върху намаляване количествата на омега-6 и наситените мазнини с повечето мазнини в диетата идващи от невъзпалителни мононенаситени мазнини.
Средната точка на протеини-към-гликемичен товар за тази противовъзпалителна диета беше с лек превес на въглехидратите към бедните на мазнини протеини. Когато общото съдържание на мазнини бъде отнесено към общия състав на противовъзпалителната диета, тогава тя ще съдържа приблизително 40% въглехидрати с нисък гликемичен товар, 30% бедни на мазнини протеини и 30% мазнини, богати на мононенаситени мазнини и бедни на омега-6 и наситени мастни киселини. Но така предложената противовъзпалителна диета беше и с ограничаване на калориите, за да предотврати възпалителното действие на излишните калории. Абсолютните количества на различните макронутриенти в предложената противовъзпалителна диета са показани в Таблица 1. при различен общ прием на калории. Обичайната препоръка за жени е 1 200 калории на ден и 1 500 калории на ден за мъже.
От Таблица 1 се вижда, че тези количества на калории, абсолютните количества на протеин са адекватни, абсолютните на въглехидрати с нисък гликемичен това са умерени (въпреки че обемът на чинията ще е значителен) и абсолютните количества на мазнини могат да се считат за малки. Съставът на макронутриентите на база грам е 1гр. мазнини (основно мононенаситени мазнини) за всеки 2гр. бедни на мазнини протеини и 3гр. въглехидрати с нисък гликемичен товар (основно зеленчуци без скорбяла и плодове).
Таблица 14.1 Количества макронутриенти при противовъзпалителна диета при различно количество калории

Клинична подкрепа за противовъзпалителна диета
Първото клинично изследване в подкрепа на такова съотношение на макронутриентите при лечение на диабет беше публикувано през 1998 г. В това изследване беше показано, че инсулиновата резистентност значително намалява в рамките на 4 дни и преди каквато и да е загуба на тегло. Внимателно контролирани клинични опити във Медицинския факултет на Харвард през 1999 г. дадоха по-нататъшна подкрепа на бързите хормонални промени и подобрена ситост, използвайки същото съотношение на макронутриентите при деца с наднормено тегло. Изследователи от Медицинския факултет на Харвард потвърдиха тези резултати за ситост при 2000 възрастни с наднормено тегло. По-скорошни изследвания в Медицинския факултет на Харвард показаха, е съотношението на макронутриентите превъзхожда намаляването на възпалението в сравнение с подобни по калории високо въглехидратни диети, въпреки че загубата на тегло е еднаква.
През 2007 г. Центърът по диабет Джослин към Медицинския факултет в Харвард обяви своите нови указания за хранене за лекуване на затлъстяване, метаболитен синдром и диабет. Тези указания по отношение на съчетаването на макронутриентите и калорийно съдържание бяха на практика идентични с онези, предложени преди повече от десет години. Следващи изследвания и други публикации от Фондацията за изследване на диабета Джослин подкрепика тази концепция за противовъзпалителна диета.
Редица други клинични изследвания на тази противовъзпалителна диета със съотношение 40% калории от въглехидрати, 30% калории от протеини и 30% калории от мазнини демонстрираха изключителна загуба на тегло, загуба на мазнини, подобрени нива на инсулин, увеличена загуба на мазнини, увеличена ситост и най-важното намаление на клетъчното възпаление.
Композицията на чинията за всяко ядене нагледно е показана на Фиг. 2.
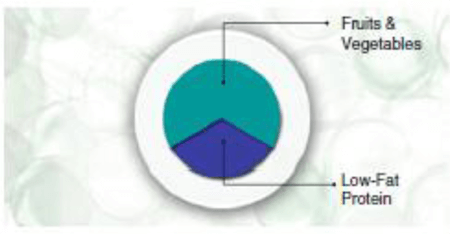
Фиг. 2 Визуален състав на типично противовъзпалително ястие
При всяко хранене, чинията трябва да бъде разделена на три еднакви секции. Една секция трябва да съдържа беден на мазнини протеин приблизително с размера и дебелината на дланта на ръката. Подходящите избори са пиле, риба и богати на протеини вегетариански източници. Другите две-трети трябва да се попълнят с цветни въглехидрати (основно зеленчуци без скорбяла и ограничени количества плодове). Това едновременно ще поддържа нисък гликемичен товар и ще осигурява подходящите количества полифеноли. Накрая, идеалната добавена мазнина трябва да е пръска екстра върджин зехтин (около 5 ml). Хормоналният успех на този хранителен баланс ще се проявява в липсата на глад и поддържане остротата на ума за следващите пет часа.
Клинични маркери за риск от възпаление и техните идеални стойности
Има три клинични маркера, които са важни за постигане, за да може една противовъзпалителна диета да се счита за успешна. Всеки от тези маркери е свързан с различен елемент на възпалителния отговор и всичките три трябва да са в подходящи граници, за да гарантиран със сигурност, че клетъчното възпаление се управлява.
Съотношение AA/EPA
Първият от тези маркери е съотношението AA/EPA. Както беше обсъдено по-рано, това е първият клиничен маркер, че клетъчното възпаление е започнало да се увеличава. Идеалното съотношение трябва да е между 1.5 и 3. Средното съотношение AA/EPA при японското население е 1,5 , докато за американското население то е средно 18. Ако съотношението AA/EPA е по-малко от 1, тогава се увеличава възможността за кървене, въпреки че има значително намаляване на сърдечносъдовите събития, в сравнение с такива при използването на статини. Докато съотношението AA/EPA остава над 1,2, няма индикации за увеличено кървене.
Съотношение TG/HDL
Това е сурогатен маркер за инсулинова резистентност в черния дроб и началото на развитие на метаболитен синдром. Идеалното съотношение трябва да е по малко от 1 (при използване на mg/dl) или по-малко от 0,4 (при използване на mmoles/ml).
HbA1c
Гликираният хемоглобин е маркер за дългосрочен контрол на кръвната захар и е показател, че е започнало развитието на диабет тип 2. Обичайно се приема, че нива на HbA1c по-големи от 6,5% са показателни за диабет и увеличена смъртност. Обаче оптималното ниво на HbA1c трябва да е 5%, тъй като по-ниски нива също се свързват с увеличена смъртност.
Тези оптимални стойности са показани в Таблица 2.
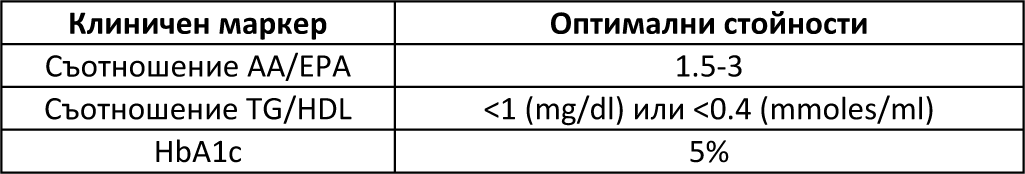
Таблица 2 Клинични маркери за противовъзпалителна диета
И трите клинични маркера трябва да са в оптималните си стойности, за да е сигурно, че клетъчното възпаление е под контрол. Ако не, или трябва да се приложи по-стриктна противовъзпалителна диета, или трябва да се обсъди добавянето на противовъзпалителни добавки.
Възможно използване на противовъзпалителни добавки
Често дори стриктна противовъзпалителна диета понякога не е достатъчна, за да се постигнат желаните стойности на описаните по-горе клинични маркери. При такива обстоятелства, има два допълнителни противовъзпалителни добавки, които могат да се обмислят.
Омега-3 мастни киселини
Най-важната от тези противовъзпалителни добавки е високо рафинирани омега-3 мастни киселини, които ще помогнат да се намали съотношението AA/EPA и по този начин да увеличат проотзвучителния потенциал на диетата. Определението за продукт от високо рафинирана омега-3 мастна киселина е такъв, който има много ниски нива на (5 ppb или по-ниски). Това е защото всички риби и рибени масла извлечени от тях съдържат PCB, които са известни като ендокринни разрушители.
Предлаганата доза трябва да е около 2,5гр. от допълнителни ЕРА и DHA на ден. Но идеалната доза ще бъде определена чрез титруване кръвните нива на майката до подходящото съотношение на AA/EPA между 1,5 и 3. Адекватните нива на тези омега-3 мастни киселини са критични не само за правилното неврологично развитие на плода, но и за намаляване на съществуващо клетъчно възпаление у майката.
Екстракти от полифеноли
Както беше споменато по-рано, плодовете и зеленчуците съдържат полифеноли. При достатъчно голяма концентрация, екстрактите от полифеноли могат да активират АМР киназата чрез взаимодействие с гена SIRT-1 gene. AMP киназата може да се счита като цертрален молекулярен превключвател, който контролира метаболизма, включителро контрола на кръвната захар. Добавянето на пречистени екстракти от полифеноли може допълнително да повиши активността на АМР киназата. Подходящата доза е 500-1000 mg полифеноли на ден.
Резюме
Намалявайки потенциалните проблеми по време на бременност се постига най-добре като първо се идентифицира популацията с най-висок риск със съществуваща метаболитна дисфункция дължаща се на възпаление причинено от начина на хранене и след това да се работи с такава популация за намаляване на клетъчното възпаление, като се използва противовъзпалителна диета както бе описано по-горе. Има различни времеви моменти, в които такава интервенция чрез диета може да бъде приложена.
Околозачеването
Най-добрият момент за подготовка за драматичните хормонални промени, които причинява бременността е да се намали клетъчното възпаление преди зачеването. Това е валидно и за двамата родители. Нарастването на процедурите за in vitro оплождане е показател за увеличаващата се трудност за успешно зачеване.
Бременност
Известно е, че диетата на майката може да има значителен ефект върху програмирането на плода с драматично въздействие върху бъдещото здраве на детето. Колкото по-стриктно майката следва противовъзпалителна диета, толкова по-добро ще е бъдещия изход за детето.
Следродов период
След раждането, мозъкът е най-бързо нараствания орган в тялото на детето. Намаляването на клетъчното възпаление в тялото на новороденото с противовъзпалителна диета е може би най-добрата застраховка за дългосрочно метаболитно здраве на детето. Това е особено вярно, тъй като се счита, че една трета от децата, родени в САЩ след 2000 г. ще се развият диабет.
Противовъзпалителните диети в основата си се базират на нови открития в областта на молекулярната биология, които подкрепят способността на такава хранителна стратегия да намали възпалението, увеличи отзвучаването и промени генната експресия. Колкото по-скоро такива диети се приложат към високорисковите популации, толкова по-малка е вероятността от дългосрочни негативни метаболитни последици за потомството.
Превод: Маня Самоковлийска
Copyright © 2016 www.vZonata.com
Референции
1. Serhan CN, Ward PA, Gilroy DW, Samir S. Fundamentals of inflammation. Cambridge, UK: Cambridge University Press; 2010.
2. Baker RG, Hayden MS, Ghosh S. NF-KB, inflammation, and metabolic disease. Cell Metab. 2011; 13(1):11-22.
3. Mariotto S, Suzuki Y, Persichini T, Colasanti M, Suzuki H, Cantoni O. Cross-talk between NO and arachidonic acid in inflammation. Curr Med Chem. 2007; 14(18):1940-4.
4. Calder PC. Dietary modification of inflammation with lipids. Proc Nutr Soc. 2002; 61(3): 345-58.
5. Sears B. The mediterranean zone. New York: Random House; 2014.
6. Spite M, Claria J, Serhan CN. Resolvins, specialized proresolving lipid mediators, and their potential roles in metabolic diseases. Cell Metab. 2014; 19(1):21-36.
7. Sears B. The anti-inflammation zone. New York: Regan Books; 2005.
8. Ndumele CE, Pradhan AD, Ridker PM. Interrelationships between inflammation, C-reactive protein, and insulin resistance. J
Cardiometab Syndr. 2006; 1(3):190-6.
9. Bastard JP, Maachi M, Lagathu C, Kim MJ, Caron M, Vidal H, et al. Recent advances in the relationship between obesity, inflammation, and insulin resistance. Eur Cytokine Netw. 2006; 17(1):4-12.
10. Mather SJ, Chianelli M. Radiolabeled cytokines. Q J Nucl Med. 1996; 40(3):290-300.
11. Rifai N, Ridker PM. Inflammatory markers and coronary heart disease. Curr Opin Lipidol. 2002; 13(4):383-9.
12. Tall AR. C-reactive protein reassessed. N Engl J Med. 2004; 350:1450-2.
13. Sears B. Toxic fat. Knoxville: Thomas Nelson; 2008.
14. Lionetti L, Mollica MP, Lombardi A, Cavaliere G, Gifuni G, Barletta A. From chronic overnu- trition to insulin resistance: the role of fat-storing capacity and inflammation. Nutr Metab Cardiovasc Dis. 2009; 19(2):146-52.
15. Hotamisligil GS. Inflammation and metabolic disorders. Nature. 2006; 444(7121):860-7.
16. De Fina LF, Vega GL, Leonard D, Grundy SM. Fasting glucose, obesity, and metabolic syndrome as predictors of type 2
diabetes: the Cooper Center Longitudinal Study. J Investig Med. 2012; 60(8):1164-8.
17. Bierhaus A, Stern DM, Nawroth PP. RAGE in inflammation: a new therapeutic target? Curr Opin Investig Drugs. 2006; 7(11):985-91.
18. Wei D, Li J, Shen M, Jia W, Chen N, Chen T, Su D, et al. Cellular production of n-3 PUFAs and reduction of n-6-to-n-3 ratios in the pancreatic beta-cells and islets enhance insulin secretion and confer protection against cytokine-induced cell death. Diabetes. 2010; 59(2):471-8.
19. Sears B. The Zone. New York: Regan Books; 1995.
20. Brenner RR. Nutritional and hormonal factors influencing desaturation of essential fatty acids. Prog Lipid Res. 1981; 20:41-7.
21. Huang S, Rutkowsky JM, Snodgrass RG, Ono-Moore KD, Schneider DA, Newman JW, et al. Saturated fatty acids activate TLR-mediated proinflammatory signaling pathways. J Lipid Res. 2012; 53(9):2002-13.
22. Lee JY, Plakidas A, Lee WH, Heikkinen A, Chanmugam P, Bray G, et al. Differential modulation of Toll-like receptors by fatty acids: preferential inhibition by n-3 polyunsaturated fatty acids. J Lipid Res. 2003; 44(3):479-86.
23. Scapagnini G, Vasto S, Sonya V, Abraham NG, Nader AG, Caruso C, et al. Modulation of Nrf2/ARE pathway by food polyphenols: a nutritional neuroprotective strategy for cognitive and neurodegenerative disorders. Mol Neurobiol. 2011; 44(2):192-201.
24. Rahman I, Biswas SK, Kirkham PA. Regulation of inflammation and redox signaling by dietary polyphenols. Biochem Pharmacol. 2006; 72(11):1439-52.
25. Ebbeling CB, Swain JF, Feldman HA, Wong WW, Hachey DL, Garcia-Lago E, et al. Effects of dietary composition on energy expenditure during weight-loss maintenance. JAMA. 2012; 307(24):2627-34.
26. Zhang X, Zhang G, Zhang H, Karin M, Bai H, Cai D. Hypothalamic IKKbeta/NF-kappaB and ER stress link overnutrition to energy imbalance and obesity. Cell. 2008; 135(1):61-73.
27. Markovic TP, Campbell LV, Balasubramanian S, Jenkins AB, Fleury AC, Simons LA, et al. Beneficial effect on average lipid levels from energy restriction and fat loss in obese individuals with or without type 2 diabetes. Diabetes Care. 1998; 21:695-700.
28. Ludwig DS, Majzoub JA, Al-Zahrani A, Dallal GE, Blanco I, Roberts SB. High glycemic index foods, overeating, and obesity. Pediatrics. 1999; 103(3):E26.
29. Agus MS, Swain JF, Larson CL, Eckert EA, Ludwig DS. Dietary composition and physiologic adaptations to energy restriction. Am J Clin Nutr. 2000; 71(4):901-7.
30. Pereira MA, Swain J, Goldfine AB, Rifai N, Ludwig DS. Effects of a low-glycemic load diet on resting energy expenditure and heart disease risk factors during weight loss. JAMA. 2004; 292(20):2482-90.
31. Joslin Diabetes Reseach Center. www.joslin.org/docs/Nutrition_Guideline_Graded.pdf. EPIC and Diabetes. 2007
32. Hamdy O, Carver C. The Why WAIT program: improving clinical outcomes through weight management in type 2 diabetes.
Curr Diab Rep. 2008; 8(5):413-20.
33. Hamdy O, Colberg SR. The diabetes breakthrough. Don Mills: Harlequin; 2014.
34. Layman DK, Boileau RA, Erickson DJ, Painter JE, Shiue H, Sather C, Christou DD. A reduced ratio of dietary carbohydrate to protein improves body composition and blood lipid profiles during weight loss in adult women. J Nutr. 2003; 133:411-7.
35. Layman DK, Shiue H, Sather C, Erickson DJ, Baum J. Increased dietary protein modifies glucose and insulin homeostasis in adult women during weight loss. J Nutr. 2003; 133(2):405-10.
36. Johnston CS, Tjonn SL, Swan PD, White A, Hutchins H, Sears B. Ketogenic low-carbohydrate diets have no metabolic advantage over nonketogenic low-carbohydrate diets. Am J Clin Nutr. 2006; 83(5):1055-61.
37. Gannon MC, Nuttall FQ. Control of blood glucose in type 2 diabetes without weight loss by modification of diet composition. Nutr Metab. 2006; 3:16.
38. Lasker DA, Evans EM, Layman DK. Moderate carbohydrate, moderate protein weight loss diet reduces cardiovascular disease risk compared to high carbohydrate, low protein diet in obese adults: a randomized clinical trial. Nutr Metab. 2008; 5:30.
39. Layman DK, Evans EM, Erickson D, Seyler J, Weber J, Bagshaw D, et al. A moderate-protein diet produces sustained weight loss and long-term changes in body composition and blood lipids in obese adults. J Nutr. 2009; 139(6):514-21.
40. Ohnishi H, Saito Y. Eicosapentaenoic acid (EPA) reduces cardiovascular events: relationship with the EPA/arachidonic acid ratio. J Atheroscler Thromb. 2013; 20(12):861-77.
41. Harris WS, Pottala JV, Varvel SA, Borowski JJ, Ward JN, McConnell JP. Erythrocyte omega-3 fatty acids increase and linoleic acid decreases with age: observations from 160,000 patients. Prostaglandins Leukot Essent Fatty Acids. 2013; 88(4):257-63.
42. Yokoyama M, Origasa H, Matsuzaki M, Matsuzawa Y, Saito Y, Ishikawa Y, et al. Effects of eicosapentaenoic acid on major coronary events in hypercholesterolaemic patients (JELIS): a randomised open-label, blinded endpoint analysis. Lancet. 2007; 369(9567):1090-8.
43. Yee LD, Lester JL, Cole RM, Richardson JR, Hsu JC, Li Y, et al. Omega-3 fatty acid supplements in women at high risk of breast cancer have dose-dependent effects on breast adipose tissue fatty acid composition. Am J Clin Nutr. 2010; 91(5):1185-94.
44. McLaughlin T, Reaven G, Abbasi F, Lamendola C, Saad M, Waters D, et al. Is there a simple way to identify insulin-resistant individuals at increased risk of cardiovascular disease? Am J Cardiol. 2005; 96(3):399-404.
45. Salazar MR, Carbajal HA, Espeche WG, Leiva Sisnieguez CE, March CE, Balbin E, et al. Comparison of the abilities of the plasma triglyceride/high-density lipoprotein cholesterol ratio and the metabolic syndrome to identify insulin resistance. Diab Vasc Dis Res. 2013; 10(4):346-52.
46. Levitan EB, Liu S, Stampfer MJ, Cook NR, Rexrode KM, Ridker PM, et al. HbA1c measured in stored erythrocytes and mortality rate among middle-aged and older women. Diabetologia. 2008; 51(2):267-75.
47. Carson AP, Fox CS, McGuire DK, Levitan EB, Laclaustra M, Mann DM, et al. Low hemoglobin A1c and risk of all-cause mortality among US adults without diabetes. Circ Cardiovasc Qual Outcomes. 2010; 3(6):661-7.
48. Ashley JT, Ward JS, Schafer MW, Stapleton HM, Velinsky DJ. Evaluating daily exposure to poly- chlorinated biphenyls and polybrominated diphenyl ethers in fish oil supplements. Food Addit Contam Part A Chem Anal Control Expo Risk Assess. 2010; 27(8):1177-85.
49. Arsenescu V, Arsenescu RI, King V, Swanson H, Cassis LA. Polychlorinated biphenyl-77 induces adipocyte differentiation and proinflammatory adipokines and promotes obesity and atherosclerosis. Environ Health Perspect. 2008; 116(6):761-8.
50. Yajnik CS. Fetal programming of diabetes: still so much to learn! Diabetes Care. 2010; 33(5):1146-8.
51. Ravelli AC, van Der Meulen JH, Osmond C, Barker DJ, Bleker OP. Obesity at the age of 50 y in men and women exposed to
famine prenatally. Am J Clin Nutr. 1999; 70(5):811-6.
52. Hanbauer I, Rivero-Covelo I, Maloku E, Baca A, Hu Q, Hibbeln JR, et al. The decrease of n-3 fatty acid energy percentage in an equicaloric diet fed to B6C3Fe mice for three generations elicits obesity. Cardiovasc Psychiatry Neurol. 2009; 2009:867041.
53. Alvheim AR, Torstensen BE, Lin YH, Lillefosse HH, Lock EJ, Madsen L, et al. Dietary lin- oleic acid elevates the endocannabinoids 2-AG and anandamide and promotes weight gain in mice fed a low fat diet. Lipids. 2014; 49(1):59-69.
54. Alvheim AR, Malde MK, Osei-Hyiaman D, Lin YH, Pawlosky RJ, et al. Dietary linoleic acid elevates endogenous 2-AG and anandamide and induces obesity. Obesity. 2012; 20(10): 1984-94.
55. Muhlhausler BS, Ailhaud GP. Omega-6 polyunsaturated fatty acids and the early origins of obesity. Curr Opin Endocrinol Diabetes Obes. 2013; 20(1):56-61.
56. Skinner MK. Endocrine disruptor induction of epigenetic transgenerational inheritance of disease. Mol Cell Endocrinol. 2014; 398:1-3.
57. Schneider JE, Brozek JM, Keen-Rhinehart E. Our stolen figures: the interface of sexual differentiation, endocrine disruptors, maternal programming, and energy balance. Horm Behav. 2014; 66(1):104-19.
58. Olshansky SJ, Passaro DJ, Hershow RC, Layden J, Carnes BA, Brody J, et al. A potential decline in life expectancy in the United States in the 21st century. N Engl J Med. 2005; 352(11):1138-45.
